یک مطالعه جدید برای اولین بار ساختار مولکولی مغزهای متاثر از بیماری آلزایمر را نشان داده است.
به گزارش سارنا به نقل از ایسنا، محققان مدلهای سهبعدی پروتئینها را در مغز تولید کردهاند، از جمله دو پروتئین که به شکل ویژه با بیماری آلزایمر مرتبط هستند و بتا آمیلوئید و تائو نام دارند.
همینطور که دانشمندان به کار برای درمان بیماریهای عصبی ادامه میدهند، مهم است که تا آنجا که ممکن است در مورد آن شناخت داشته باشند.
انباشته شدن این پروتئینها در مغز یا علت آلزایمر هستند یا پیامدهای آن و ما هنوز کاملاً مطمئن نیستیم کدام.
به لطف تیمی از محققان در دانشگاه لیدز بریتانیا، اکنون نگاهی بسیار دقیق به این بیماری، از نحوه چیدمان آن تا ریزترین جزئیات میکروسکوپی پروتئینها را داریم.
رنه فرانک عصبشناس دانشگاه لیدز میگوید: این اولین نگاه اجمالی به ساختار مولکولهای درون مغز انسان، سرنخهای بیشتری از آنچه برای پروتئینها در بیماری آلزایمر اتفاق میافتد، ارائه میدهد. اما این همچنین یک رویکرد تجربی را تعیین میکند که میتواند برای درک بهتر طیف گستردهای از سایر بیماریهای عصبی ویرانگر به کار رود.
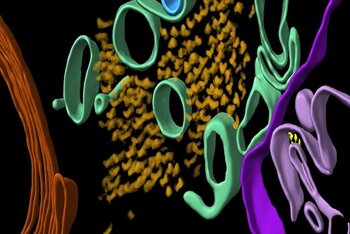
محققان از تعدادی تکنیک تصویربرداری پیشرفته از جمله توموگرافی کرایو الکترونی(cryoET) که از خوانش پرتوهای الکترون برای ترسیم ساختارهای سه بعدی بافت بیحرکت در دماهای بسیار پایین استفاده میکند، برای اسکن بافت مغز پس از مرگ بیماران آلزایمر استفاده کردند.
توموگرافی کرایو الکترونی امکان تصویربرداری بدون تثبیت شیمیایی یا کمآبی را که ساختار بافت بیولوژیکی را مختل کند، فراهم میکند. به این معنی که دانشمندان اکنون میتوانند حجمهای سه بعدی بافت را با وضوح یک میلیون بار کوچکتر از یک دانه برنج بازسازی کنند.
محققان در مقاله منتشر شده خود آوردهاند: مشخصات میکروسکوپی نوری آمیلوئید در مغز آلزایمری اساس طبقهبندی تشخیصی و بیماری را تشکیل میدهد و این در حالی است که ساختار درجای آمیلوئید در مغز انسان ناشناخته است. امید است که با نگاهی دقیق به این پروتئینها بتوانیم نحوه تشکیل تودهها و تأثیر آنها بر مغز را بهتر درک کنیم.
در پروتئینهای بتا آمیلوئید، مخلوطی از ساختارهای نخمانند میکروسکوپی به نام فیبریلها و ساختارهای دیگر یافت شد. در پروتئینهای تائو نیز دستهای از رشتهها در خطوط مستقیم وجود داشت، اگرچه به نظر میرسد آرایش آنها بسته به جایی که پروتئینها در مغز قرار دارند، متفاوت است.
در حالی که این خوشهها به یکدیگر شبیه بودند، از نظر نحوه جهتگیری و پیچ خوردگی رشتههای تائو و همچنین در اندازه فیبریلهای بتا آمیلوئید تفاوتهایی وجود داشت.
محققان میگویند این اولین نگاهی است که ما به این پروتئینها در این سطح از جزئیات داشتهایم و هنوز زود است که درباره اهمیت آنچه فاش شده است، چیزی بگوییم. اکنون که این تکنیک کارایی خود را نشان داده است، میتوان آن را روی بافتهای طیف وسیعتری از اهداکنندگان مغز امتحان کرد.
این اطلاعات بیشتر در مورد چگونگی نگاه به این پروتئینهای مختلف و نقاط مختلف پیشرفت آلزایمر را نشان میدهد و با مقایسه این ساختارها در طول زمان، باید بتوانیم ببینیم این بیماری چگونه ایجاد میشود.
در واقع، این تیم پژوهشی فکر میکند که این رویکرد میتواند در تجزیه و تحلیل علل ریشهای انواع بیماریهای عصبی مفید باشد، بنابراین میتوان انتظار داشت در آینده بیشتر درباره آن بشنویم.
محققان میگویند: گروههای بزرگتر اهداکنندگان مختلف مبتلا به بیماری آلزایمر، در مناطق مختلف مغز و در مراحل اولیه بیماری آلزایمر ممکن است نشان دهند که ساختار فضایی آمیلوئید چگونه با ساختارهای مختلف آسیب شناسی عصبی فردی مرتبط است.
همچنین استفاده از این رویکردها در مورد سایر بیماریهای عصبی که بسیاری از آنها انواع مرتبط یا همپوشانی با نوروپاتولوژی آمیلوئید دارند، مهم خواهد بود.
این پژوهش در مجله Nature منتشر شده است.










نظر بدهید